伴随着疫情的发展及返工高峰的到来,通过及时检测自己的体温变化、高度警惕发热,有助于提前发现感染者,体温计作为疫情应急产品之一,瑞旭集团结合医疗器械法规及体温计的注册申报要求总结了体温计产品的注册申报过程的技术要求供参考。
依据医疗器械法规,体温计属于第二类医疗器械,根据其工作原理的不同可分为红外体温计、电子体温计、玻璃体温计。
一、体温计产品概述
1. 红外体温计
1.1红外体温计结构组成:
通常由红外温度传感器、探头套、显示单元、供电电路、测量电路组成。
1.2红外体温计工作原理:
自然界中一切温度高于绝对零度(—273℃)的物体都会辐射出红外线,而辐射出的红外线的能量和温度是正比的关系。利用这种关系,可以通过测量物体的红外线强度来计算出它的温度。
1.3 红外体温计典型结构:
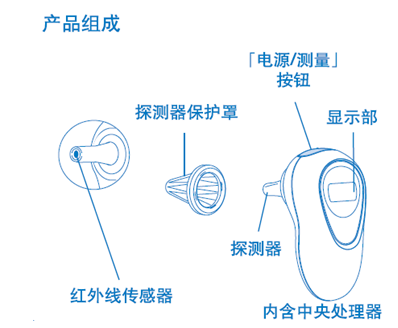
2. 电子体温计
2.1 电子体温计结构组成:
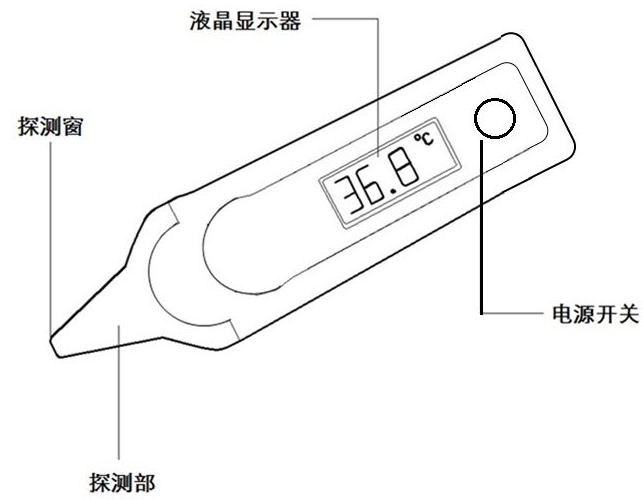
一般由探测器(探头保护套附件)、传感器、CPU控制模块、显示模块、提示音模块、电源供应模块组成。
2.2 电子体温计工作原理:
放置在测量部分顶端的热敏电阻作为温度传感装置,当外界被测热源的温度发生改变时,热敏电阻的阻值将随之改变,内部微处理器对测量回路中热敏电阻的阻值变化,进行换算、处理、修正后,将测量温度以数字的形式在显示屏上显示出来,同时蜂鸣音响,测量过程结束。
2.3 电子体温计产品典型结构:
产品结构框图如下:
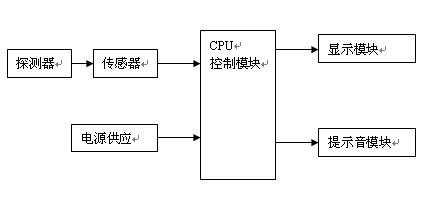
图1 产品结构框图
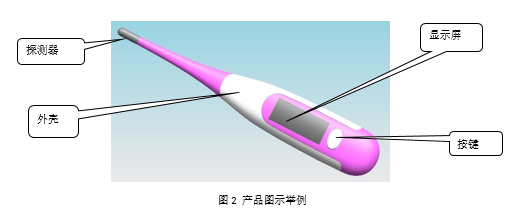
3. 玻璃体温计
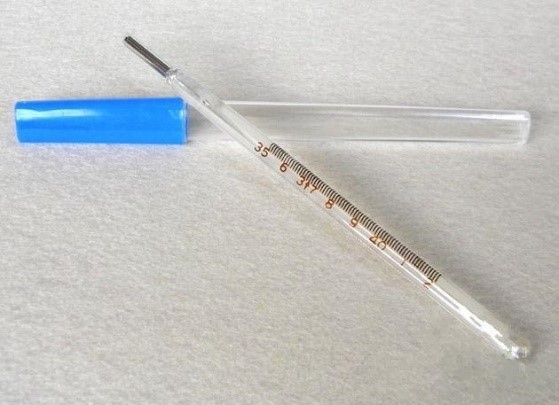
3.1 玻璃体温计结构组成
通常由玻璃管、感温泡、汞或其他感温液体和刻度尺标组成。
3.2 玻璃体温计工作原理:
采用汞或其他液体的热胀冷缩原理测量温度。
3.3 玻璃体温计产品典型结构:
二、体温计产品分类信息
一级 | 二级 | 三级 | 产品描述 | 预期用途 | 品名举例 | 管理类别 |
07医用诊察和监护器械 | 03生理参数分析测量设备 | 04体温测量设备 | 通常由玻璃管、感温泡、汞或其他感温液体和刻度尺标组成。采用汞或其他液体的热胀冷缩原理测量温度。 | 用于临床测量患者体温。通常放置于人体的口腔、腋下、肛门部位测量。 | 玻璃体温计、体温计 | Ⅱ |
常由热电偶或其他接触式测温传感器、显示单元,供电电路,测量电路组成。将传感器通过接触传导测得的温度转换为电信号进行显示或数据输出。 | 用于临床测量患者体温。通常放置于人体的口腔、腋下、肛门、额头部位测量。 | 电子体温计 | Ⅱ | |||
通常由红外温度传感器、探头套、显示单元、供电电路、测量电路组成。采用红外感温方法测量温度显示或者数据输出。 | 用红外方法测量临床测量患者体温,通常用于测量患者耳道、额头部位温度。 | 电子体温计、额温计、红外耳温计 | Ⅱ |
三、体温计临床试验要求
体温计产品已经列入免于进行临床试验的医疗器械目录中,可免于进行临床试验,注册申报过程只需要提交临床评价报告,免于进行临床试验的描述如下:
序号 | 分类编码 | 产品名称 | 产品描述 | 类别 |
353 | 07-03-04 | 额温计 | 通常由红外温度传感器、探头套、显示单元、供电电路、测量电路组成。采用红外感温方法测量温度显示或者数据输出。应提供临床准确性的临床验证资料。 | Ⅱ |
354 | 07-03-04 | 体温测量设备(无源) | 通常由玻璃管、感温泡、汞或其他感温液体和刻度尺标组成。采用汞或其他液体的热胀冷缩原理测量温度。用于临床测量患者体温。通常放置于人体的口腔、腋下、肛门部位测量。豁免情况不包括使用了新材料、新作用机理、新功能的产品。 | Ⅱ |
355 | 07-03-04 | 医用电子体温计 | 医用电子体温计为间歇接触式监控患者体温的电子装置,可由塑胶外壳、电路板、温度测量部件、显示屏、电源等组成;可按设计、技术参数、附加辅助功能、预期用途等不同分为若干型号,供测量人体体温或女性监测排卵周期等用,不包括预测模式,也不包括医用红外体温计。产品性能指标采用下列参考标准中的适用部分,如:GB/T 21416-2008 医用电子体温计。 | Ⅱ |
356 | 07-03-04 | 耳腔式医用红外体温计 | 耳腔式医用红外体温计可由塑胶外壳、电路板、温度测量部件、显示屏、电源、隔离膜等组成;可按设计、技术参数、附加辅助功能、预期用途等不同分为若干型号;通过热辐射显示被测人体耳腔体温。需提供临床准确度与临床重复性报告。产品性能指标采用下列参考标准中的适用部分,如:GB/T 21417.1-2008医用红外体温计 第1部分:耳腔式。 | Ⅱ |
四、体温计技术要求
体温计技术要求中部分重要性能指标对比
产品类别 | 红外体温计 | 电子体温计 | 玻璃体温计 |
适用标准 | GB/T 21417.1-2008医用红外体温计 第1部分:耳腔式 | GB/T 21416-2008 医用电子体温计 | GB 1588-2001 玻璃体温计 |
适用的指导原则 | 耳腔式医用红外体温计注册技术审查指导原则 | 医用电子体温计注册技术审查指导原则 (2017年修订版) | / |
温度显示范围 | 不窄于35.0℃~42.0℃ | 不窄于35.0℃—41.0℃ | / |
最大允许误差 | 规定的温度显示范围内最大允许误差:在35.0℃~42.0℃内,最大允许误差±0.2℃。 规定的温度显示范围外最大允许误差:在35.0℃~42.0℃外,最大允许误差±0.3℃。 变化环境条件下最大允许误差:应符合本标准6.3.1的要求。 最大允许临床误差:临床重复性不应超过±0.3℃范围。 | 温度显示范围A低于35.3或高于41.0时,最大允许误差B±0.3;当A为35.3—36.9或39.1—41.0时,B±0.2;当A为37.0—39.0时,B为±0.1(单位为摄氏度) | 新生儿棒式体温计示值允差:±0.15℃,其余体温计示值允差:-0.15/+0.10℃。 |
分辨力 | / | 0.1℃或更小 | 温度的最小分度值为0.1℃,分度应均匀 |
重复性 | 不应超过±0.3℃ | 重复性误差S≤0.2℃ | / |
其他 | 见标准GB/T21417.1—2008医用红外体温计第1部分:耳腔式 | 见标准GB/T 21416-2008 《医用电子体温计》 | 见标准GB 1588-2001 玻璃体温计 |
五、体温计主要参考技术标准或规范
表1红外体温计可参考相关标准
标准编号 | 标准名称 |
GB 9706.1—2007 | 医用电气设备第一部分:安全通用要求 |
GB/T 14710—2009 | 医用电器环境要求及试验方法 |
GB 15980—1995 | 一次性使用医疗用品卫生标准 |
GB/T16886.1—2011 | 医疗器械生物学评价第1部分:风险管理过程中的评价与试验 |
GB/T 16886.5—2017 | 医疗器械生物学评价第5部分:体外细胞毒性试验 |
GB/T 16886.7—2015 | 医疗器械生物学评价第7部分:环氧乙烷灭菌残留量 |
GB/T 16886.10—2017 | 医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验 |
YY/T 0466.1—2009 | 医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求 |
YY 0505—2012 | 医用电气设备第1—2部分:安全通用要求并列标准:电磁兼容要求和试验 |
GB/T21417.1—2008 | 医用红外体温计第1部分:耳腔式 |
YY/T 0664—2008 | 医疗器械软件软件生存周期过程 |
YY/T 0708—2009 | 医用电气设备第1—4部分:安全通用要求并列标准:可编程医用电气系统 |
表2电子体温计可参考相关标准
标准编号 | 标准名称 |
GB 9706.1—2007 | 医用电气设备第一部分:安全通用要求 |
GB/T 191-2008 | 《包装储运图示标志》 |
GB/T 9969-2008 | 《工业产品使用说明书 总则》 |
GB/T 14710—2009 | 医用电器环境要求及试验方法 |
GB/T16886.1—2011 | 医疗器械生物学评价第1部分:风险管理过程中的评价与试验 |
GB/T 16886.5—2017 | 医疗器械生物学评价第5部分:体外细胞毒性试验 |
GB/T 16886.10—2017 | 医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验 |
GB/T 21416-2008 | 《医用电子体温计》 |
YY/T 0466.1—2009 | 医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求 |
YY 0505—2012 | 医用电气设备第1—2部分:安全通用要求并列标准:电磁兼容要求和试验 |
YY/T 0316-2008 | 《医疗器械 风险管理对医疗器械的应用》 |
表3 玻璃体温计可参考相关标准
标准编号 | 标准名称 |
GB/T16886.1—2011 | 医疗器械生物学评价第1部分:风险管理过程中的评价与试验 |
GB/T 16886.5—2017 | 医疗器械生物学评价第5部分:体外细胞毒性试验 |
GB/T 16886.10—2017 | 医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验 |
GB 1588-2001 | 《玻璃体温计》 |
YY/T 0466.1—2009 | 医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求 |
YY/T 0316-2008 | 《医疗器械 风险管理对医疗器械的应用》 |
六、体温计注册审批时限
国产体温计产品在一般审批情况下,其注册审批周期为80工作日(不含补正过程):
- 技术审评:60个工作日,发补后再60个工作日;
- 行政审批:20个工作日。
瑞旭集团提醒各企业,若通过应急审批进行的注册申报,则技术审评和行政审批时间根据各省规定加快审批,但是应急审批的批件有效期也是有规定,一般期限不会超过1年。
