众所周知,“现场核查”是特医食品在中国流向市场之前的必备环节,是通过专家老师们严格细致的审核与考察,决定申报企业是否有资格作为特医食品生产者的重要依据之一。而特医食品在国内尚属于一个新兴的食品类别,从《食品安全法》确立其注册制度到现在为止也不过五年时间,而从第一款产品获批到现在还不到三年。因此,大多数企业对其还是停留在“只知其名”的阶段。那特医食品的现场核查究竟包括了哪些内容,谁来进行核查以及如何判定是否通过呢?请继续往下看。
特医食品现场核查分类
根据《食品安全法》、《特殊医学用途配方食品注册管理办法》以及《食品生产许可审查通则》中的相关内容,可以将特医食品涉及到的现场核查类别总结如下:

产品注册的现场核查,谁来查?查什么?
1.谁来查?
《特殊医学用途配方食品注册管理办法》(下面简称《管理办法》)规定:国家食品药品监督管理总局核查机构(现在由国家市场监管总局食品审评中心代替)负责特殊医学用途配方食品注册审评过程中的现场核查工作,并通知申请人所在地省级食品药品监督管理部门参与现场核查。简单讲:产品注册时的现场核查,国家查,省参与。
2.查多久?
《管理办法》规定:1)核查机构应当自接到审评机构通知之日起20个工作日内完成对申请人的现场核查,并出具核查报告;2)核查机构应当自接到审评机构通知之日起40个工作日内完成对临床试验的现场核查,并出具核查报告。
3.查什么?
为保障特医食品注册工作的顺利开展,原国家食药总局制定了《管理办法》的配套文件,其中包括《特殊医学用途配方食品注册生产企业现场核查要点及判断原则(试行)》(后简称《核查要点及判断原则》)。《核查要点及判断原则》将申请人的现场核查内容分为:
生产能力、研发能力、检验能力、生产场所、设备设施、人员、物料管理、生产过程管理
这8个部分共24个核查项目,其中5个为关键核查项目,包括:
生产企业资质、研发能力、生产质量管理体系建立、生产条件、生产用水
其余19个为一般核查项目。此外,根据技术审评需要,还可以对申请人提交的注册申报资料涉及的其他项目进行现场核查。
对于临床试验的现场核查,《管理办法》仅说明“应该对临床试验的真实性、完整性、准确性等情况进行现场核查”,除此之外并无类似的配套文件及更加具体的规定。
4.如何判定?
在这24个核查项目中,上述的5个关键核查项目的核查结论分为“符合”以及“不符合”;而其余19个一般核查项目的核查结论分为“符合”、“基本符合”和“不符合”。根据核查结论的汇总数量分别做出如下核查决定: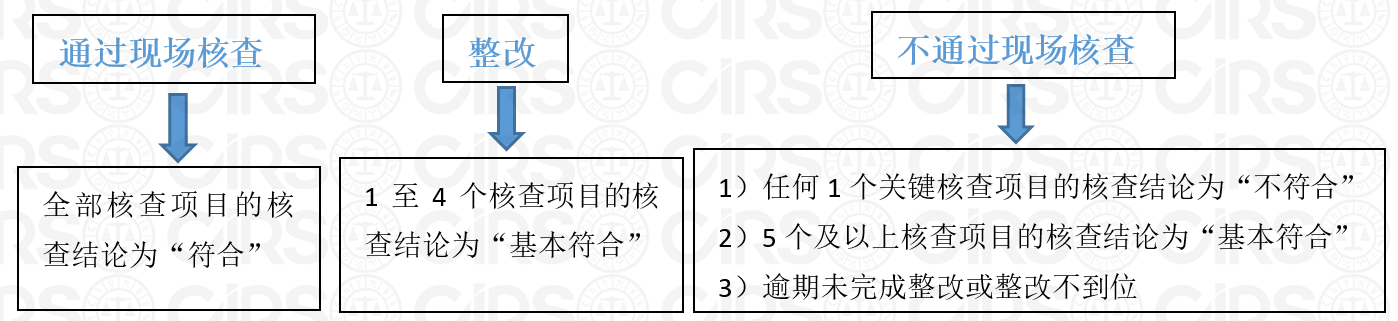
其中,整改应在10日内完成。申请人认为整改到位的,由当地省级食品安全监督管理部门予以核查确认并签字,再由核查机构做出通过现场核查的决定。
生产许可的现场核查,谁来查?查什么?
1.谁来查?查多久?
《食品生产许可管理办法》规定:特殊医学用途配方食品的生产许可,由省、自治区、直辖市市场监督管理部门负责。《食品生产许可审查通则》(后简称《审查通则》)规定:负责对申请人实施日常监管的食品安全监督管理部门应当派观察员参加现场核查工作,但不作为核查组成员,不参与评分及核查结论的判定;观察员对现场核查程序、过程、结果有异议的,可在现场核查结束后3个工作日内书面向许可机关报告。简单讲:特医食品的生产许可由省级部门进行现场核查,而负责对申请人进行食品安全日常监管的部门进行参与和监督。
《审查通则》同时规定:核查组应当自接受现场核查任务之日起10个工作日内完成现场核查。
2.查什么?如何查?
《审查通则》规定:生产许可现场核查范围主要包括生产场所、设备设施、设备布局和工艺流程、人员管理、管理制度及其执行情况、查验试制产品检验合格报告这6个部分。而《特殊医学用途配方食品生产许可审查细则》(后简称《审查细则》)对此6个部分分别进行了细化以及补充,以适用于特医食品。
对于核查方式方法,《审查通则》规定:对核查项目采取核查现场、查阅文件、核对材料及询问相关人员等方法实施现场核查。必要时,核查组可以对申请人的食品安全管理人员、专业技术人员进行抽查考核。
3.如何判定?
类似的,食品生产许可的现场核查也有一张评分表:《食品、食品添加剂生产许可现场核查评分记录表》(后简称《评分记录表》)。此表将上述提到的生产许可现场核查的6个部分共分为了34个核查项目,其中“试制产品检验合格报告”这个部分单独列为了一个项目,且将其核查得分标准设置为“1分,0.5分,0分”;而其余33个核查项目则分化在了剩下的5个核查部分中,且核查得分标准均为“3分,1分,0分”。
《评分记录表》规定:核查项目单项得分无0分且总得分率≥85%的,判定为通过现场核查;核查项目有0分项或者总得分率<85%的,则判定为未通过现场核查。
此外,以下情况直接作“未通过现场核查”结论:
1)申请人不配合实施现场核查的;
2)现场核查时生产设备设施不能正常运行的;
3)申请人存在隐瞒有关情况或提供虚假申请材料的;
4)其他因申请人主观原因导致现场核查无法正常开展的
4.检查与整改
《审查通则》规定:对于判定结果为通过现场核查的,申请人应当在1个月内对核查中发现的问题进行整改,并将整改结果向负责对申请人实施日常监管的食品安全监督管理部门书面报告。而负责对申请人实施日常监管的部门应当在3个月内对获证企业开展一次监督检查,并且应重点检查现场核查中发现的问题是否已进行整改。
结语
不论是产品注册的现场核查还是生产许可的现场核查,都是基于对各自申报材料的技术审评。而现场核查的主要目的,就是核验申请人的实际情况是否与申报材料相一致、是否真实、是否和所生产的产品相适应以及是否符合相关法律法规的要求。瑞旭已将以上提到的涉及特医食品现场核查的法律法规整理在我们的官网中,点击此处即可查看或下载。
我们的服务:
