自保健食品备案信息系统于2017年5月1日正式上线运营起,截止2021年2月22日,公开已取得备案的进口保健食品有123款(因有些已备案产品还未公开,因此实际更多)。受限于备案类保健食品的剂型需符合《保健食品备案产品主要生产工艺(试行)》等法规的要求,目前仅以下剂型允许用于备案保健食品:片剂、硬胶囊、软胶囊、口服液和颗粒剂。
众所周知,保健食品备案制是前所未有的,这一政策大大缩短了行政审批流程,也减轻了企业负担。国家市场监督管理总局(原CFDA)为了进一步响应简政放权的政策,势必需要有更多的保健食品符合备案制度。为了扩大保健食品备案产品剂型,市场监管总局于2021年2月20日正式发布了《保健食品备案产品剂型及技术要求(2021年版)》以及配套修订的《保健食品备案可用辅料及其使用规定(2021年版)》(下称“21版辅料目录”),将凝胶糖果和粉剂纳入保健食品备案剂型,并将于2021年6月1日起施行。
与目前可用剂型不同,此次纳入备案的凝胶糖果和粉剂属于食品形态。为了帮助企业更加直观的了解到中国保健食品备案相关法规要求,此文以凝胶糖果形态的进口保健食品为例,重点介绍进口保健食品的备案流程,备案所需证明文件和资料要求,以及备案工作的注意事项。
进口保健食品备案流程简图

上图为保健食品备案账号申请和产品备案申请的流程简图。如图所示,进口保健食品首次备案(提交卷宗)前,备案人需要先获取备案管理信息系统登录账号(以下简称“备案账号”)。获取备案账号后,才能进行产品备案卷宗的线上提交。通常在一切顺利的情况下,从资料准备到最终拿到产品备案凭证,整个周期为8个月左右,其中比较耗时的是:证明文件的开具,样品的稳定性测试,官方的技术审评,补正和再次技术审评。通常为了缩短备案周期,瑞旭集团建议备案账号的申请和保健食品备案的申请同时准备,一旦获取备案账号,即刻线上提交产品备案申请是最为快速的操作。另外,有些工作,比如样品的测试和资料(包括证明文件)的准备也是可以同时进行的,这样可以进一步压缩申报的周期。
企业备案账号的申请和产品备案的申请,首先需通过官方网站(保健食品备案管理信息系统)进行线上提交,审核通过后再线下提交纸质资料。线上第一步:点击获取登陆账号,申请保健食品备案账号。线上第二步:通过获取的登陆账号,登陆备案系统,申请保健食品的备案凭证。保健食品备案管理信息系统的网站首页如下:
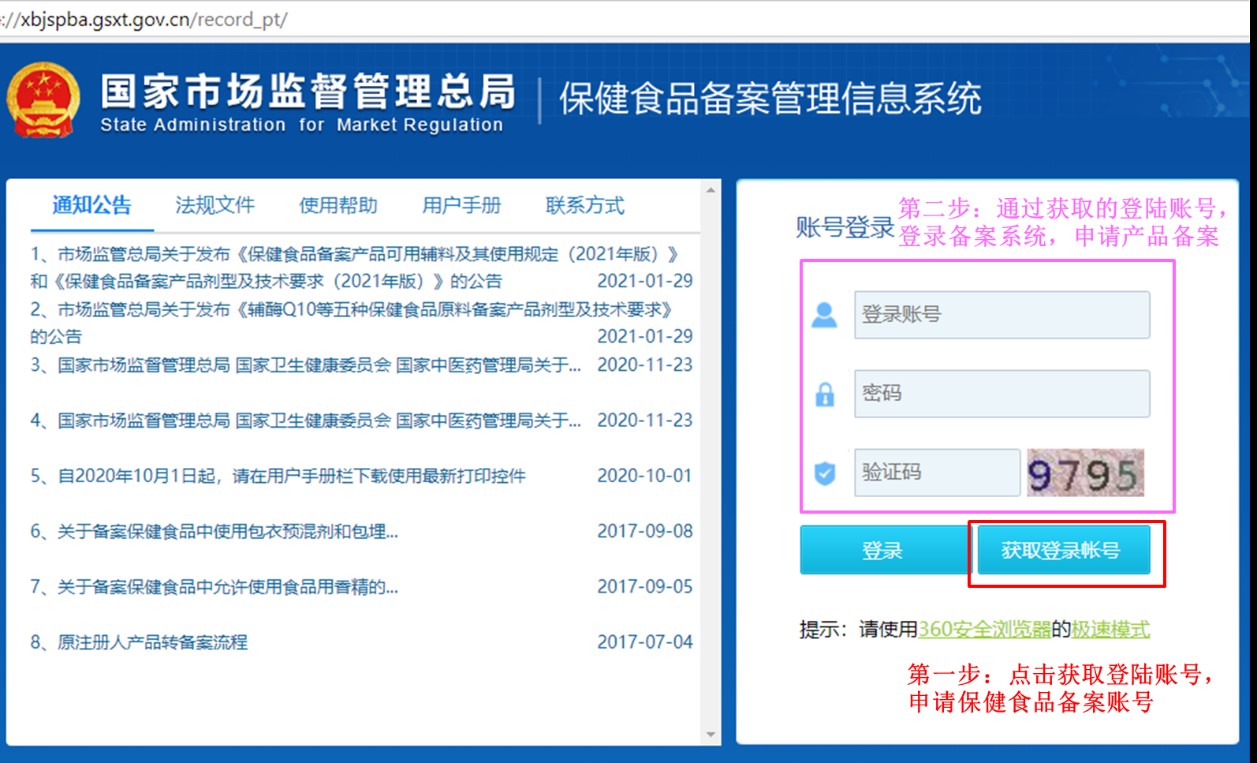
第一步:点击获取登陆账号后,进入如下页面,按要求填写企业信息和上传相关的证明文件,即可申请备案账号。

第二步:通过获取的登陆账号,登陆备案系统,进入如下页面。点击“新产品申请备案”,再点击“备案申请”,按要求填写产品信息,生产企业信息和境内申报机构信息,并上传产品附件资料,即可申请保健食品的备案凭证。

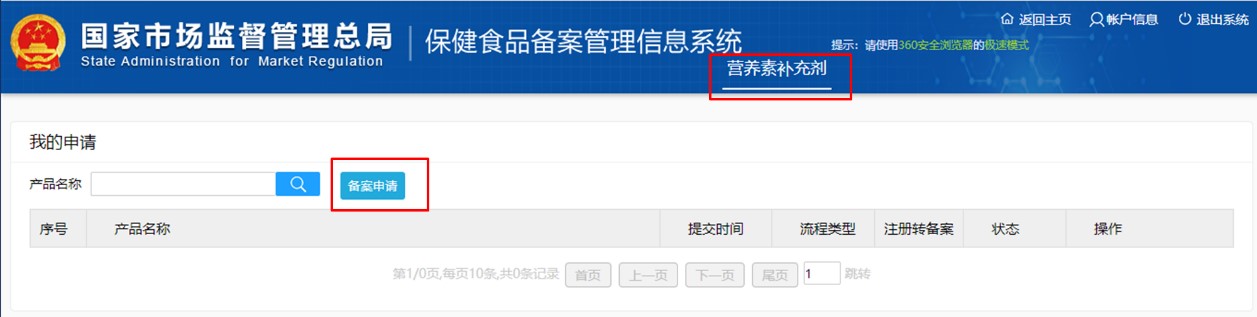
无论是剂型为片剂、硬胶囊、软胶囊、口服液或颗粒剂的保健食品,还是为凝胶糖果或粉剂的保健食品,其进口保健食品的备案流程都是一样的。企业除了需要清楚了解到保健食品的备案流程,保健食品企业备案账号的申请和保健食品产品备案凭证的申报所需要的证明文件和相关材料也是非常需要关注的。若材料准备不符要求,备案流程就会被打乱,甚至重头开始。下面,瑞旭集团根据法规要求和实操经验,整理了相关的材料要求,并列举一些实际申报过程中应注意的点。
首先,关于备案人备案账号的申请,所需的证明文件如下:
1. 产品生产国(地区)政府主管部门或法律服务机构出具的备案人为上市保健食品境外生产厂商(符合其所在国(地区)上市要求的法人或其他组织)的资质证明文件
2. 保健食品备案账号申请联系人授权委托书
3. 备案人法人代表的护照扫描件
以上的三个文件看似简单,实则也有许多细节需要注意,比如护照扫描件必须要清晰完整,且是彩色的;联系人授权委托书中如有法人代表的签字,签字必须和护照签字统一。
再者,关于进口保健食品备案申请,又需要准备哪些材料和证明文件?
1.保健食品备案登记表,以及备案人对提交材料真实性负责的法律责任承诺书
2.备案人主体登记证明文件(国产保健食品:营业执照,保健食品生产许可证等。进口保健食品:产品生产国(地区)政府主管部门或者法律服务机构出具的备案人为上市保健食品境外生产厂商的资质证明文件)
3. 产品配方材料:产品配方表
4.产品生产工艺材料,包括生产工艺简图及说明
5. 安全性和保健功能评价材料
5.1 三批中试以上规模工艺生产的产品功效成分或标志性成分、卫生学、稳定性检验报告
5.2 原料、辅料合理使用的说明,及标签说明书、产品技术要求制定符合相关法规的说明
6. 直接接触保健食品的包装材料种类、名称、相关标准
7. 产品标签说明书样稿
8.产品技术要求材料
9. 具有合法资质的检验机构出具的符合产品技术要求全项目检测报告
9.1食品检验机构的资质证明文件
9.2三批符合产品技术要求的全项目检验报告
10.产品名称相关检索材料
11.其他表明产品安全性和保健功能的材料
进口保健食品备案额外需要准备的材料
12.备案人主体登记证明文件(产品生产国(地区)政府主管部门或者法律服务机构出具的备案人为上市保健食品境外生产厂商的资质证明文件)
13. 备案产品上市销售一年以上证明文件(产品生产国(地区)政府主管部门或者法律服务机构出具的保健食品类似产品上市销售一年以上的证明文件,或者产品境外销售以及人群食用情况的安全性报告)
14. 产品生产国(地区)或者国际组织与保健食品相关的技术法规或者标准原文,保证生产质量管理体系有效运行的自查报告,符合良好生产质量管理规范的证明文件
15.产品生产国(地区)上市的包装、标签、说明书实样、中文译本及公证书
16.由境外备案人常驻中国代表机构办理备案事务的,应当提交《外国企业常驻中国代表机构登记证》及其复印件。境外备案人委托境内的代理机构办理备案事项的,应当提交经过公证的委托书原件以及受委托的代理机构营业执照复印件
这里需要注意,目前可用的备案产品剂型(片剂、硬胶囊、软胶囊、口服溶液、颗粒剂)均为现行《中国药典》中收载的剂型,技术要求中指标设定参考现行《中国药典》和《食品安全国家标准 保健食品》(GB16740)。而此次纳入备案的凝胶糖果和粉剂属于食品形态,其技术指标无相应的国家标准,同时,其在备案时可用的辅料与现有的备案产品剂型也不完全相同。因此法规对两类产品的技术要求、可用辅料等均做出了特定或额外要求。
下文以凝胶糖果形态的保健食品为例,具体说明该形态产品的技术要求和可用辅料等重要内容。
凝胶糖果概述:
用于保健食品备案的凝胶糖果是以纳入保健食品原料目录的原料,与食糖或糖浆或甜味剂、食用胶(或淀粉)等辅料,经相关工艺制成具有弹性和咀嚼性的糖果。
凝胶糖果产品说明书有关重点内容:
说明书中的内容 | 相关要求 |
适宜人群 | 4岁以上人群 |
食用量及食用方法 | 每日最大食用量为20g;食用方法为“应充分咀嚼后服用”。 |
规格 | 每粒不超过6g |
注意事项 | 请勿吞服。食用本产品的人群应当具备有咀嚼固体食物的能力。同时对于适宜人群含有“13岁以下”的,建议增加“应在成人监督下充分咀嚼食用”的提示。 |
凝胶糖果产品技术要求:
产品技术要求根据凝胶糖果食品的特点,对凝胶糖果类产品的感官要求、理化指标、微生物指标均做出了具体规定(不涉及产品使用的原料辅料在制成产品时还需要符合的其他规定)。以理化指标为例,要求如下:
项 目 | 指 标 |
铅(以Pb计),mg/kg | ≤0.5 |
总砷(以As计),mg/kg | ≤0.5 |
总汞(以Hg计),mg/kg | ≤0.3 |
干燥失重,g/100g | 植物胶型:≤18.0 动物胶型:≤20.0 淀粉型:≤18.0 混合型:≤35.0 夹心型、包衣和包衣抛光型:符合主体糖果的要求 其他胶型:≤20.0 |
还原糖(以葡萄糖计), g/100g | ≥10.0 夹心型、包衣和包衣抛光型:符合主体糖果的要求。 无糖胶型凝胶糖果不设该指标。 |
单糖和双糖,g/100g | ≤0.5,仅无糖胶型凝胶糖果设定该指标 |
凝胶糖果主要生产工艺:
溶胶、化糖、熬煮、混合、调配、过滤、充气、成型、干燥、拌砂、包衣、抛光、涂挂、包装等。
凝胶糖果的使用范围:
目前,已纳入保健食品原料目录中的维生素矿物质为原料的产品可以使用凝胶糖果食品形态。
凝胶糖果可用辅料及相关要求:
1. 凝胶糖果可用辅料
21版辅料目录中共包括197个辅料。由于凝胶糖果和粉剂属于食品形态,对可用于凝胶糖果和粉剂的辅料进行了进一步的筛选。以凝胶糖果为例,可用于凝胶糖果的辅料共151个,不可用辅料包括使用标准仅为药品标准的辅料(保留“纯化水”)、糖果中不可用的辅料等,具体如下所示:β-环状糊精、丁基羟基茴香醚(BHA)、对羟基苯甲酸酯类及其钠盐(对羟基苯甲酸甲酯钠,对羟基苯甲酸乙酯及其钠盐)、二丁基羟基甲苯(BHT)、二氧化硅、富马酸、红曲黄色素、滑石粉、环己基氨基磺酸钠、抗坏血酸棕榈酸酯、硫酸钙、迷迭香提取物、羧甲基淀粉钠、糖精钠、维生素E、盐酸、异构化乳糖液、乙酸钠、硬脂酸钙、单糖浆、低取代羟丙纤维素、黑氧化铁、红氧化铁、糊精、黄氧化铁、交联聚维酮、交联羧甲纤维素钠、聚维酮K30、聚乙二醇、可溶性淀粉、羟丙纤维素、甘油三乙酯、无水磷酸氢钙、乙基纤维素、预胶化淀粉、蔗糖、棕氧化铁、明胶空心胶囊、共聚维酮、聚乙烯吡咯烷酮、麦芽糊精、异麦芽酮糖醇、枸橼酸、无水枸橼酸、大豆磷脂、羟丙基淀粉空心胶囊。
2. 辅料可用的质量标准
凝胶糖果备案时不得使用以下24个辅料中的药品标准:阿拉伯胶、D-甘露糖醇、二氧化钛、蜂蜡、甘油、甲基纤维素、明胶、木糖醇、羟丙基甲基纤维素、三氯蔗糖、山梨酸及其钾盐(以山梨酸计)、山梨糖醇和山梨糖醇液、羧甲基纤维素钠、天门冬酰苯丙氨酸甲酯(又名阿斯巴甜)、微晶纤维素、硬脂酸镁、马铃薯淀粉、木薯淀粉、乳糖、食用葡萄糖、食用小麦淀粉、食用玉米淀粉、薄荷脑、碳酸镁。
3. 辅料可用的用量
21版辅料目录中有15个辅料额外列出了在凝胶糖果中的生产允许使用量,包括:苯甲酸及其钠盐(以苯甲酸计)、赤藓红及其铝色淀(以赤藓红计)、二氧化钛、红花黄、聚甘油脂肪酸酯、葡萄皮红、甜菊糖苷、苋菜红及其铝色淀(以苋菜红计)、胭脂红及其铝色淀(以胭脂红计)、叶绿素铜钠盐、乙酰磺胺酸钾、硬脂酸、栀子黄、栀子蓝、辛,癸酸甘油酯。
通过以上的保健食品备案流程和备案所需资料来看,实则保健食品备案的技术要求并不是特别高。相对保健食品注册来说,备案无需进行毒理试验、功能试验,也无需研发报告等资料。但是对于进口保健食品企业来说,保健食品备案账号的申请和产品的备案申请还是会面临以下几个难点:
- 对法规的透彻理解:保健食品备案相关的法规较多,内容也较为丰富,只有对法规非常熟悉的技术人员才能做到全面理解,尽可能的少走弯路。
- 有丰富的实操经验:瑞旭集团发现在准备企业备案账号和产品备案凭证的申报资料时,除了法规中的细节要求,有些不成文要求可能没法在法规中量化或说明,只有经常和审评老师沟通,具有相关备案经验的技术人员才能了解到这些细节问题,能精准把握尺度。
- 对法规政策的实时跟踪:法规中大部分内容的要求是不会变化的,但是对于一些细节问题的要求,审评专家会根据他们的评估监测,不定期的细化。另外法规也有可能不断在更新。以瑞旭集团举例,食品事业部有专门的人员监测法规的变动并通知所有人,任何技术人员在处理新项目时,若发现评审专家的要求有变化,也会通知给部门所有人,以此来避免下个项目走弯路。
- 对企业联系人的要求:联系人必须拥有中国手机号码,且会说中文。另外联系人至少在一定程度上对保健食品法规和提交的资料了解,因为联系人需要接听审评老师的电话,并与审评老师沟通解释,以在一定程度上减少补正的可能性,让项目更为顺利。
以上几个难点,进口保健食品企业若要攻克,需要花费不少精力和财力。因此绝大部分的进口备案类保健食品企业选择委托境内的代理机构办理备案事项。瑞旭集团可提供保健食品注册和保健食品备案服务,企业若有任何需要,欢迎随时联系我们。
相关链接:
我们的服务:
