近日,药监局发布了2017年国家医疗器械不良事件监测年度报告,对2017年医疗器械不良事件监测工作进行了汇总,统计了2017年不良事件报告数量,并对报告的来源、医疗器械管理类别、产品类别等进行分析。
全国医疗器械不良事件报告总体情况
2017年,国家药品不良反应监测中心共收到《医疗器械不良事件报告表》376,157份,比2016年增长了6.49%。其中,死亡可疑不良事件报告211份,严重伤害可疑不良事件报告57,754份,百万人口平均医疗器械不良事件报告数为282份。
截至2017年12月31日,在“全国医疗器械不良事件监测系统”中注册的基层用户数量较2016年有所增长,共注册用户253,250家。其中,医疗器械生产企业11,898家,占注册基层用户总数的4.70%;经营企业128,625家,占注册基层用户的50.79%;使用单位112,727家,占注册基层用户的44.51%
2017年医疗器械不良事件报告统计分析
(一)按报告来源统计分析
2017年,全国上报的医疗器械不良事件报告中,使用单位上报326622份,占总报告数的86.83%;生产企业上报8655份,占总报告数的2.30%;经营企业上报40754份,占总报告数的10.83%;还有120份报告来自个人,占总报告数的0.03%;此外还有6份报告来源不详(图1)。
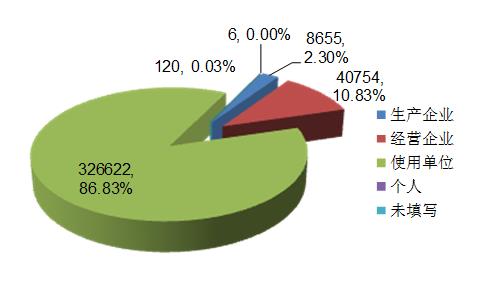
图1 2017年医疗器械不良事件报告来源情况
(二)按事件伤害程度统计分析
2017年,全国上报的医疗器械不良事件报告中,事件伤害为死亡的报告共211份,占总报告数的0.06%;事件为严重伤害的报告共57754份,占总报告数的15.35%;事件伤害为其他的报告共318192份,占总报告数的84.59%(图2)。2017年,各类伤害程度的报告所占比例与2016年基本一致。

图2 2017年医疗器械不良事件报告事件伤害程度情况
(三)按医疗器械管理类别统计分析
2017年,全国上报的医疗器械不良事件报告中,涉及Ⅲ类医疗器械的报告154,192份,占总报告数的40.99%;涉及Ⅱ类医疗器械的报告181,175份,占总报告数的48.16%;涉及Ⅰ类医疗器械的报告25,555份,占总报告数的6.79%;部分报告涉及的器械管理类别不详,共15,235份,占总报告数的4.05%。数据显示,涉及Ⅲ类和Ⅱ类医疗器械的报告占绝大多数,这与医疗器械风险程度高低相吻合(图3)。

图3 2017年医疗器械不良事件报告涉及产品管理类别情况
(四)按医疗器械产品名称统计分析
2017年,全国上报的医疗器械不良事件报告中,报告数量排名前十位的无源医疗器械分别为一次性使用输液器、一次性使用无菌注射器、静脉留置针、宫内节育器、导尿包、角膜接触镜、玻璃体温计、导尿管、医用输液贴和一次性使用心电电极,占总报告数的35.89%,详见表1。
排名 | 产品名称 | 报告数 | 占报告总数的百分比 |
1 | 一次性使用输液器 | 43538 | 11.57% |
2 | 一次性使用无菌注射器 | 31736 | 8.44% |
3 | 静脉留置针 | 14757 | 3.92% |
4 | 宫内节育器 | 12441 | 3.31% |
5 | 导尿包 | 7348 | 1.95% |
6 | 角膜接触镜 | 7266 | 1.93% |
7 | 玻璃体温计 | 6786 | 1.80% |
8 | 导尿管 | 4756 | 1.26% |
9 | 医用输液贴 | 3772 | 1.00% |
10 | 一次性使用心电电极 | 2662 | 0.71% |
合计 | 135062 | 35.89% |
表1 报告数量排名前十位的无源医疗器械
2017年,全国上报的医疗器械不良事件报告中,报告数量排名前十位的有源医疗器械分别为病人监护仪、输液泵和注射泵、心电图机、电子血压计、血液透析机、呼吸机、生化分析仪、特定电磁波治疗机、婴儿培养箱、血糖仪,占总报告数的9.78%,详见表2。
编号 | 产品名称 | 报告数 | 占报告总数的百分比 |
1 | 病人监护仪 | 12917 | 3.43% |
2 | 输液泵和注射泵 | 7947 | 2.11% |
3 | 心电图机 | 3109 | 0.83% |
4 | 电子血压计 | 3105 | 0.83% |
5 | 血液透析机 | 2423 | 0.64% |
6 | 呼吸机 | 2328 | 0.62% |
7 | 生化分析仪 | 1383 | 0.37% |
8 | 特定电磁波治疗机 | 1355 | 0.36% |
9 | 婴儿培养箱 | 1167 | 0.31% |
10 | 血糖仪 | 1063 | 0.28% |
合计 | 36797 | 9.78% |
表2 报告数量排名前十位的有源医疗器械
(五)按涉及实际使用场所统计分析
2017年,全国上报的医疗器械不良事件报告中,使用场所为“医疗机构”的报告311,860份,占82.91%;使用场所为“家庭”的报告33,460份,占8.90%;使用场所为“其他”的报告6,853份,占1.82%;使用场所未填写的报告23,984份,占6.38%(图4)。使用场所的复杂性是分析不良事件发生原因时需要考量的因素之一。

图4 2017年医疗器械不良事件报告涉及实际使用场所情况
医疗器械警戒快讯发布情况
2017年,国家药品不良反应监测中心共发布6期《医疗器械警戒快讯》,包括生物可吸收性血管支架系统、除颤/监护系统、胰岛素笔式注射器、植入式心脏复律除颤器等32条产品安全性信息。
