这个春节,朋友圈不再被奶茶,车厘子霸屏,朋友圈里出现最多的肯定是口罩!口罩!!口罩!!!新型冠状病毒来袭,疫情严峻。为了有效的隔离病毒传播,装备一定要配齐:口罩,体温计,防护服,医用隔离眼罩,医用隔离鞋套等。
为应对新型冠状病毒感染的肺炎疫情,在国家药监局(NMPA)指导下,近期,多个省级药品监管部门迅速启动医疗器械应急审批程序,按照“统一指挥、早期介入、随到随审、科学审批”的原则和确保产品安全、有效、质量可控的要求,对疫情防控所急需的医疗器械开展应急审批。
备受境外企业关注的进口医疗器械是否可以走“绿色通道”,北京市,黑龙江省,重庆市,甘肃省等多地药品监督管理部门发文时也做出了相关说明。
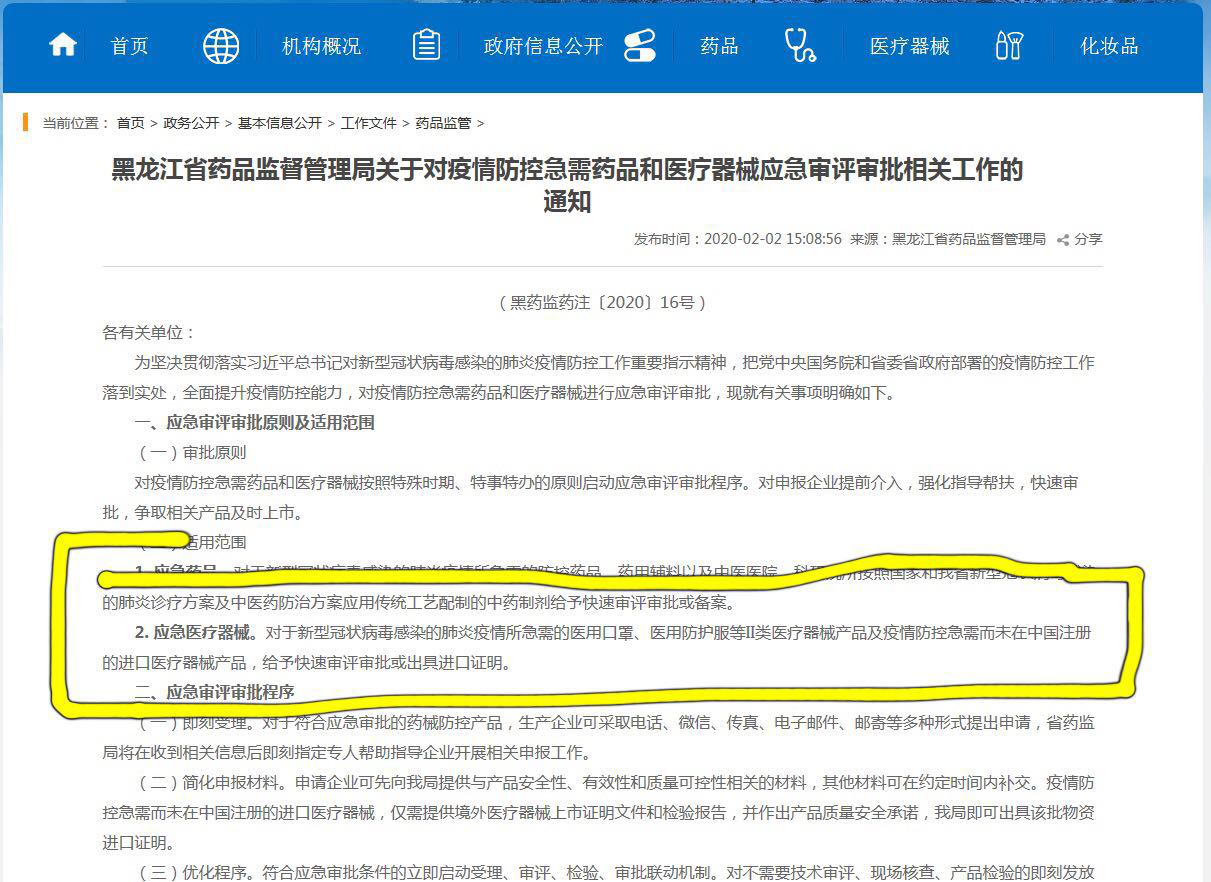
敲黑板!划重点!也就是说 海外医疗器械产品 只要符合要求 也能享受“绿色通道” 快速进入中国市场。
医疗器械应急审批程序适用于哪些产品?
对于第III类医疗器械,该程序适用于突发公共卫生事件应急所需,且在我国境内尚无同类产品上市,或虽在我国境内已有同类产品上市,但产品供应不能满足突发公共卫生事件应急处理需要。
对于第I类和第II类医疗器械,则需具体遵循省级相关规定。如浙江省发布的《关于发布防控新型冠状病毒感染的肺炎疫情所需医疗器械应急审批程序的公告》(2020年 第2号)中包括医用口罩,医用防护服,红外测温设备等,不在此范围内,但申请人认为属防控疫情所需应予以应急审批的,也可以按本程序申请。
医疗器械应急审批程序申请流程
第III类医疗器械向国家药品监督管理局申报,具体流程参考国家药品监督管理局医疗器械技术审评中心发布的《一文读懂医疗器械的应急审批》。
第I类和第II类医疗器械向医疗器械生产企业所在地省、自治区、直辖市药品监督管理局申报。以省市发布的医疗器械应急审批程序相关文件为准,如浙江省医疗器械应急注册审批流程图。
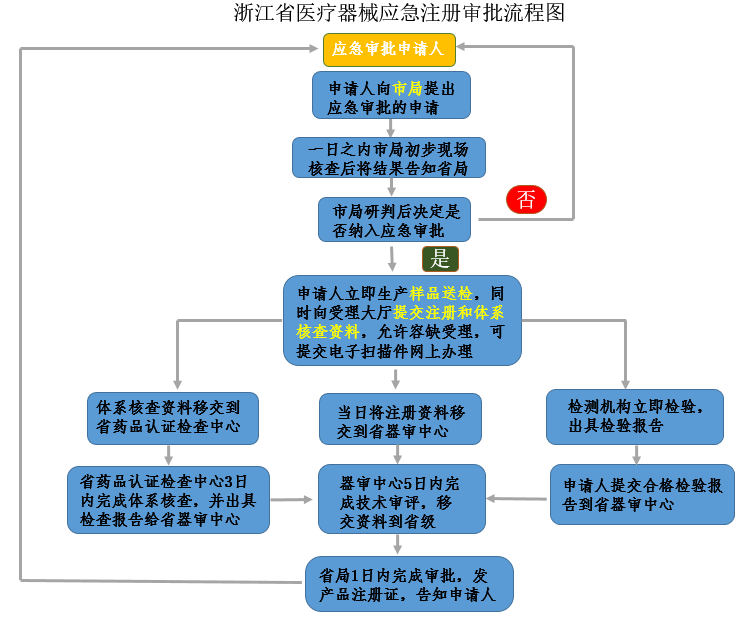
1.应急审批并不能豁免注册检验、体系核查和技术审评,仍需按照流程办理,但是可以将时间压缩。
2.浙江,上海,山西,贵州等省市都表明:此次疫情期间,启动的医疗器械应急审批事项,申请人免于缴纳注册费用。
疫情结束后,产品还能继续销售吗?
在已出台的省级医疗器械应急审批程序相关文件中的规定如表1所列。
表1 多省关于应急审批产品批件有效期说明
地区 | 应急审批产品有效期说明 |
浙江省 | 应急审批的注册证有效期暂定为6个月,注册证备注栏标注“防控新型冠状病毒感染的肺炎疫情应急审批 |
广东省 | 对仅限于防控疫情所需作出的行政许可,相关批件应注明“仅在防控新型冠状病毒感染的肺炎疫情期间内有效 |
黑龙江省 | 用于疫情防控特殊审批的产品,批准证明文件在疫情结束后自动失效 |
内蒙古自治区 | 本公告在新型冠状病毒感染肺炎疫情解除后自行废止,所批准产品注册证内容自行失效。拟继续生产的,按照《医疗器械注册管理办法》规定重新申请注册 |
